糖尿病大鼠视网膜血管消化铺片技术的改进及技巧探讨
何 洁 1韩 静 2郝改梅 1吴 晏 2王 伟 1
【摘要】目的 建立适合视网膜血管的消化方法,探讨一种稳定可重复的视网膜血管消化铺片技术。方法 一次性腹腔注射链脲佐菌素建立糖尿病大鼠模型,另设正常组,36周后取材固定,分别采用胶原酶、胰蛋白酶及胃蛋白酶-胰蛋白酶联合消化法三种方法消化视网膜血管,观察并对比三种方法制作的铺片效果;对铺片进行形态学观察,并比较正常组与模型组毛细血管面积密度及内皮细胞/周细胞数比值的变化。结果胶原酶消化程度不足以显示出视网膜血管结构;胰蛋白酶消化法残存较多的神经胶质细胞及其他组织细胞,不能完全显示视网膜血管网;胃蛋白酶-胰蛋白酶联合消化法能完整显示出视网膜血管网,形态结构清晰,可以观察血管的面积分布、管径变化及管壁细胞结构。与正常组相比,模型组视网膜毛细血管排列紊乱,毛细血管面积密度显著升高(P<0.01);内皮细胞增生,周细胞减少,内皮细胞数与周细胞数比值升高(P<0.01)。结论 胃蛋白酶-胰蛋白酶联合消化法是最适合视网膜血管的消化方法,结合良好规范的操作技巧可以稳定的重复视网膜血管消化铺片技术。
【关键词】视网膜血管消化铺片;糖尿病视网膜病变;消化法
中图分类号:R34
文献标识码:A
文章编号:1002-4379(2015)01-0001-05
DOI:10.13444/j.cnki.zgzyykzz.2015.01.001
基金项目:1国家科技部“十二五”支撑计划项目(2012BAI29B07)2北京中医药大学在读研究生项目(2014-JYBZZ-XS-024)
作者单位:1北京中医药大学基础医学院,北京100029 2北京中医药大学科研实验中心
通讯作者:王伟,
E-mail:wangwei@bucm.edu.cn
Improvements and discussion on technology of diabetic rats’retinal vascular digest preparations HE
Jie,HAN Jing,HAO Gaimei,et al. Basic Medical College,Beijing University of Chinese Medicine,Beijing 100029,China
【Abstract】OBJECTIVE To set up a suitable method to digest retina, and to explore a stable and repeatable technology of retinal vascular digest preparations. METHODS A diabetic rats’model group was set up by intraperitoneal injection of streptozotocin and fixed after 36 weeks. Another group was set up as control group. Applied collagenase, trypsin and pepsin-trypsin digestion respectively to digest retinal vessels, then observed and compared the effects of preparations of the three methods; applied morphological observation to preparations and compared capillary area density and change of ratio between endothelial cells and pericytes of the model group and normal group. RESULTS Collagenase digestion was not sufficient to exhibit retinal vascular structure; trypsin digestion was not able to exhibit the complete retinal vascular network with much remains of neurogliocyte and other tissue cells; pepsin-trypsin digestion exhibits complete retinal vascular network with clear morphological structure, where the area distribution of vessels, pipe diameter changes, and wall cells structure could be observed. Compared with the normal group, retinal capillary of model group appears disorder and capillary area density significantly increases(P< 0.001); endothelial cells proliferate and pericytes decrease, making ratio between them increases(P<0.001). CONCLUSIONS The pepsin-trypsin digestion was the most suitable method to digest retina, which could repeat retinal vascular digest preparations technology steadily combined with good practices of operating skills.
【Keywords】retinal vascular digest preparations; diabetic retinopathy; digestions
视网膜血管消化铺片是研究糖尿病视网膜病变(diabetic retinopathy,DR)的金标准之一 〔1〕,可以定性、定量地评估视网膜血管形态,包括血管走行、面积分布和管壁细胞结构。但由于市场上消化酶的品种、品质不断更替变化,加之操作步骤繁琐,要制作标准的、理想的铺片难度较大。本实验对视网膜血管消化铺片技术进行改进,并观察对比三种方法制作的铺片效果,以期找到最适合视网膜血管的消化方法,探讨一种稳定可重复的视网膜血管消化铺片的技术,为进一步研究DR的发病机制及防治提供可行的技术支持。
1 材料及方法
1.1动物和主要实验器材
SPF级雄性SD大鼠40只,体重300~350 g,购自北京维通利华实验动物技术有限公司(许可证号SCXK京2012-0001)。胶原酶I(Sigma,C0130),胰蛋白酶(Amresco,1443C193),胃蛋白酶(Amresco,0171C464);链脲佐菌素(streptozotocin,STZ,Sigma S0130);Optium Xceed“安妥超越”血糖仪与Optium试纸(雅培糖尿病护理有限公司);黏附载玻片;透明玻璃培养皿;烧杯;玻璃棒;眼科剪;眼科镊;眼科金属小铲刀;10 ml离心管;37℃培养箱(荣华,SPX-150B-Z);OLYMPUS显微镜(TH-200)等。
1.2建立糖尿病动物模型
大鼠饲养于北京中医药大学科研实验中心清洁级动物室,室内温度20℃~25℃,相对湿度50%~ 60%,换气次数10~15次/小时,12小时光照维持,昼夜循环。大鼠自由摄食饮水,颗粒饲料喂养。造模前对大鼠进行眼部及全身状况检查,以排除原发疾患,按随机数字表法将其分为糖尿病模型组及正常组,各20只。适应性喂养1周后,禁食12小时,STZ溶解于0.1 mmol/L柠檬酸钠缓冲液(冰盒中新鲜配制,pH 4.5),一次性腹腔注射STZ 65 mg/kg建立糖尿病大鼠模型,正常组注射等量柠檬酸钠缓冲液。1周后尾静脉采血检测血糖,禁食12 h血糖≥16.7 mmol/L者为糖尿病大鼠。大鼠每周监测体重,每4周检测血糖,饲养36周。
1.3 眼球取材及固定
大鼠腹腔注射3%戊巴比妥钠30 mg/kg后处死,见眼球由红润变为苍白后立即摘除眼球。一只手打开眼睑以暴露眼球,另一只手用弯钳从上往下用力挤压,使眼球突出,然后从眼球根部轻柔夹住视神经,摘出眼球。用眼科金属小铲刀的尖端扎破角膜,去除晶状体,然后自睫状体平坦部后面(近锯齿缘)剪开巩膜,去除角膜及眼前段,将眼球后段(含视神经部)置于4%多聚甲醛中浸泡,4℃冰箱保存至少24小时。
1.4制备视网膜血管消化铺片
缓冲液清洗:将固定后的眼球后段置于盛有0.01 M PBS缓冲液(pH 7.4)的平皿中,以视神经为中心将后眼杯剪成三等分的瓣片,使用金属小铲刀钝性分离视网膜与脉络膜。弃掉脉络膜后的视网膜浸泡于PBS中,摇床上顺时针方向旋转水洗,每十分钟更换一次PBS,至少更换三次,可室温摇床过夜。
消化:清洗后的视网膜分别用胶原酶、胰蛋白酶、胃蛋白酶-胰蛋白酶联合消化:(1)0.05%胶原酶I(直接称粉末溶于TESCA缓冲液,TESCA缓冲液配方:50 mM Tris乙磺酸,0.36 mM氯化钙,pH 7.4,37℃溶解,现配现用,多余的溶液要放于-20℃冻存),每瓣视网膜10 ml,于37℃培养箱中消化,间隔30分钟摇晃一次,消化6小时。消化液浑浊时更换新的消化液。(2)3%胰蛋白酶(1∶250,用0.1 M Tris buffer pH 7.8配制),每瓣视网膜10 ml,于37℃培养箱中消化,间隔30分钟摇晃1次,消化5小时。消化液浑浊时更换新的消化液。(3)5g/L胃蛋白酶(20ml/L HCl溶解),每瓣视网膜10 ml,于37℃培养箱中消化30分钟,轻柔地上下震荡(注意不要将视网膜粘附在离心管的管盖上),使感光器层与视网膜分离,当视网膜层变为半透明状、表面绒絮状物质分解疏松,即可将其转移至3%胰蛋白酶消化液中继续消化1.5小时左右(具体消化时间要依视网膜的状态而定),间隔30分钟摇晃1次,至消化液浑浊、视网膜更加透明、表面绒絮物质变少,停止消化。
铺片:用宽头吸管将视网膜转移至盛有PBS的玻璃平皿中,换成玻璃吸管轻轻的吹打,即重复吸进-吐出的动作,定向对准视网膜上绒絮物质较多的部位。注意先将玻璃吸管反复吸取胰酶,以包被管头,防止吹打视网膜时,视网膜粘附在吸管内;使用玻璃吸管可加大吹打力度,但不能用力过猛损坏血管结构。更换新的PBS以漂洗视网膜,帮助去除非血管组织,直至PBS中没有崩解的神经组织碎片,视网膜呈现出完全透明的血管网的状态(此时视网膜血管网似“蜘蛛网”般轻薄透明,极易丢失)。在洁净的载玻片上滴一滴水,用宽头吸管将血管网转移到载玻片上,依靠水的表面张力将血管网展开,可以温和的摇晃帮助其展开。室温自然干燥备染。
PAS染色:视网膜血管铺片蒸馏水浸洗5分钟,1%高碘酸氧化5分钟,蒸馏水换洗3次,每次5分钟;Schiff试剂室温染色15分钟;亚硫酸冲洗液换洗3次,每次2分钟,流水冲洗10分钟,蒸馏水浸洗5分钟;Mayer苏木素复染2分钟,流水冲15分钟;逐级酒精脱水,二甲苯透明,中性树脂封片。
1.5毛细血管面积密度及内皮细胞与周细胞数比值的分析
选取胃蛋白酶-胰蛋白酶联合消化成功的铺片,正常组和模型组各选取10张进行形态学观察,采用盲法于400倍显微镜下,每张铺片选取3个不重叠的视野,采集图像后用图像分析软件(Image-Proplus 6.0)进行图像分析,测定视网膜毛细血管面积密度;分别计数内皮细胞与周细胞个数,取平均值,并计算其比值(E/P)。
1.6 统计学方法
实验数据采用SPSS 20. 0统计软件分析比较,各组实验数据用x±s表示,组间数据比较采用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1三种消化方法的比较
(1)胶原酶消化:视网膜消化程度不够,残存过多的其他组织,不能显示出视网膜血管结构(图1);消化时间长,且需要不断更换消化液,耗费试剂;几乎无法展片观察。(2)胰蛋白酶消化:视网膜消化程度不均匀,残存较多的神经胶质细胞及其他组织细胞,不能完全显示视网膜血管网(图2);延长消化时间则容易导致消化过度、视网膜血管结构破坏;消化后血管网残存绒絮物较多,吹打时易损坏血管网(图3);展片困难。(3)胃蛋白酶-胰蛋白酶联合消化:视网膜消化程度均匀,能完整显示出视网膜血管网,形态结构清晰,可以观察血管的面积分布、管径变化、内皮细胞及周细胞的数量等(图4~5);消化时间短,可有效缩短实验时间;易于吹打去除残存的神经组织,便于展片。
2.2光学显微镜下视网膜血管网的形态
消化后的正常组大鼠视网膜血管从视盘分支形成“树枝”状结构(图4),由小动脉、小静脉及毛细血管网组成。血管管壁由内皮细胞和周细胞组成,它们之间的比例接近1∶1。内皮细胞为单层,连续平行分布于血管长轴,核淡染,呈长椭圆形。周细胞位于内皮细胞外,略突出管壁,分布不连续,核深染,呈小圆形或三角形(图5)。
模型组视网膜血管中周细胞数量明显减少,或因细胞凋亡形成影细胞,表现为无细胞核的周细胞(图6);内皮细胞呈局灶性或弥漫性增生,增生后形态各异,在毛细血管近微静脉端内皮细胞核肥大,呈圆形或椭圆形,浅染;在近微动脉端内皮细胞核边缘卷曲折叠,核变得细长,呈月牙状,深染(图7);并有毛细血管瘤(图8)及血管管腔闭锁(图9)的形成。
2.3毛细血管面积密度及内皮细胞与周细胞数比值的变化
造模36周后的大鼠,模型组与正常组相比(表1),毛细血管面积密度显著升高(P<0.01),内皮细胞增生明显,周细胞减少,内皮细胞数与周细胞数比值升高(P<0.01)。
3 讨论
1960年Kuwabara和Cogan 〔2〕首先用胰蛋白酶或胃蛋白酶消化掉视网膜非血管组织,得到视网膜血管网并进行染色,从而发明了视网膜血管消化铺片技术;1963年A shton 〔3〕对此技术加以改进,得到了可以清晰观察血管走行分布和管壁细胞结构的铺片。此后又经过各国学者的不断探索、完善,进一步奠定了视网膜消化铺片技术的基础。但是由于市场上消化酶的品种、品质不断更替变化,加之技术操作步骤繁琐、难点多,对操作者的技巧、娴熟度要求较高,往往很难得到理想的铺片效果,尤其是在大批量制作视网膜消化铺片时,能否得到均一、标准的铺片直接影响到实验结果的分析。所以本实验通过对比三种消化方法制作的铺片质量,得出胃蛋白酶-胰蛋白酶联合消化法制作的铺片效果最理想:视网膜消化程度最均匀,能清晰完整的显示出视网膜血管网的形态结构,便于观察血管的走行分布、管径变化情况及管壁细胞状况等;消化时间短,能有效缩短整个实验周期,有利于大批量制作;且消化完全的视网膜在后期的吹打、展片过程中比较容易操作,降低了实验难度。
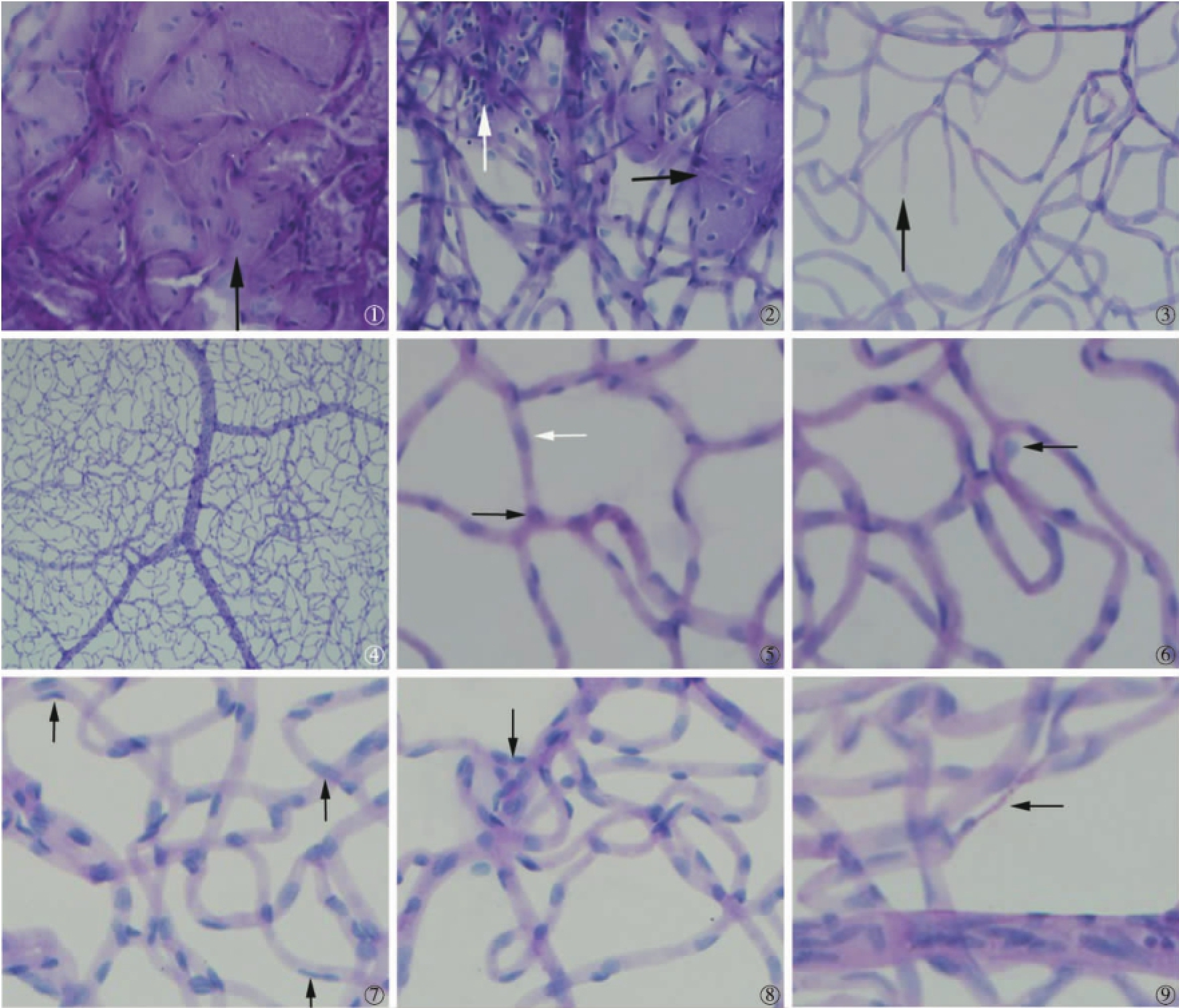
图1 胶原酶消化的铺片:视网膜消化程度不够,残存过多的其他组织,不能显示出视网膜血管结构(×400)。图2 胰蛋白酶消化的铺片:视网膜消化程度不均匀,残存较多的神经胶质细胞↑及其他组织细胞→,不能完全显示视网膜血管网(×400)。图3 胰蛋白酶消化的铺片:视网膜消化不完全,吹打时血管网破损,或消化过度时血管破损(×400)。图4 胃蛋白酶-胰蛋白酶联合消化的铺片:视网膜血管网显示完整,呈“树枝状”分布(×200)。图5 胃蛋白酶-胰蛋白酶联合消化的铺片(正常组大鼠):视网膜血管内皮细胞着色稍浅,核较大呈椭园形←,周细胞深染,核小呈园型或三角形→(×400)。图6 胃蛋白酶-胰蛋白酶联合消化的铺片(模型组大鼠):周细胞凋亡,表现为无细胞核的周细胞(×400)。图7 胃蛋白酶-胰蛋白酶联合消化的铺片(模型组大鼠):内皮细胞增生,呈月牙形、梭形、多边形↑(×400)。图8 胃蛋白酶-胰蛋白酶联合消化的铺片(模型组大鼠):视网膜血管内皮细胞增生排列紊乱形成毛细血管瘤(×400)。图9 胃蛋白酶-胰蛋白酶联合消化的铺片(模型组大鼠):毛细血管管腔闭锁(×400)。注:全部是PAS染色
表1 视网膜消化铺片毛细血管面积密度及内皮细胞与周细胞数的变化(x±s)

崔彦等 〔4〕用胶原酶消化制作视网膜血管铺片,但是我们在实验中发现,胶原酶的消化力度不够,消化程度不均匀,残存过多其他组织,无法显示完整的视网膜血管结构。虽然胶原酶是生物学实验中常用的消化酶,但它主要水解结缔组织中胶原蛋白成分,仅对细胞间质有消化作用而对上皮细胞影响不大。视网膜色素上皮层则主要由上皮细胞组成,因此胶原酶并不适合用于消化视网膜。潘琳等 〔5〕用胰蛋白酶消化制作视网膜血管铺片效果较好,但早期使用的这种胰蛋白酶实际上是一种含有胰蛋白酶、糜蛋白酶、弹性蛋白酶、淀粉酶、脂酶、核糖核酸酶的胰腺粗提取物。现在市场上流通的胰蛋白酶是胰腺精提物,只含有胰蛋白酶,所以我们在实验中单独使用胰蛋白酶消化视网膜血管效果不理想。胃蛋白酶是一种消化性蛋白酶,由胃腺的主细胞合成,以酶原颗粒形式分泌,经胃液中盐酸激活后具有消化蛋白质的能力。1836年由Theodor在实验中发现并命名为胃蛋白酶,也是胃中惟一的一种蛋白水解酶,其最适pH值为1~2。因此用稀盐酸配制胃蛋白酶,提供胃蛋白酶作用的酸性环境,以助其发挥消化功能。在消化视网膜时,胃蛋白酶能快速去除感光层细胞,加之胰蛋白酶强力水解细胞间蛋白质使细胞离散的作用,可有效缩短消化时间。当然,胰蛋白酶的活性与其浓度、温度和作用时间有关,在pH为8.0、温度为37℃时,胰酶溶液的消化能力最强。因Ca 2+、Mg 2+和血清、蛋白质可降低胰酶的活性,所以配制胰酶溶液时应选用不含Ca 2+、Mg 2+的试剂。
实验中眼球的固定及水洗步骤也很关键。首先,与固定整个眼球相比,只固定含视网膜的半个眼杯更利于后期视网膜血管消化铺片的制作,这样固定的视网膜不会皱缩的难以展开,而且固定充分。次之,固定时间长短对后期视网膜血管消化铺片的制作有很大影响。孟丽娜等 〔1〕将三组眼球按固定时间的不同进行比较,结果发现:固定时间过短,固定不充分,视网膜血管会变形;固定时间长,固定液渗透组织的能力就强,往往脉络膜粘附从而影响血管网的观察。我们经过反复实践发现,固定24~72小时较为合适,视网膜血管既不会变形亦不会产生组织粘附。最后我们探索了缓冲液清洗视网膜的方式及时间。以往实验者直接用流水冲洗视网膜,但是视网膜本身特别小且轻薄,极易丢失。我们发现将视网膜放在平皿中,并使用摇床顺时针方向旋转,同时频繁更换缓冲液,不仅能充分洗去视网膜中残留的固定液,使内界膜与神经细胞层分离,而且不易使视网膜丢失。另外,固定视网膜时间的长短影响缓冲液清洗效果,因此固定较久的视网膜需要清洗较长时间。
目前,全世界有3.47亿人患有糖尿病 〔6〕,而全球1%的盲症可归咎于糖尿病 〔7〕。糖尿病视网膜病变是糖尿病最严重和常见的微血管并发症之一 〔8〕,也是工作年龄人群主要的致盲原因,其发病率呈逐年增加的趋势,预计到2030年,全世界将有3亿DR患者 〔9〕。所以对DR发病机制及防治的深入研究十分必要,建立成熟的视网膜血管消化铺片技术能帮助我们更直观、更深入地了解DR微血管的病变情况,使干预病情转归成为可能。本实验在国内外报导的视网膜血管消化铺片技术的基础上进行改进,解决了市场上缺乏适用于消化视网膜的消化酶的困境,找到了合适的消化方法,建立了稳定可重复的铺片技术。当然,我们仍然需要进一步探索如何简化操作步骤,得到更好的铺片效果。
参考文献
[1]孟丽娜,刘延,董晓光.小鼠血管灌注造影视网膜铺片操作技术及技巧探讨[J].眼科新进展,2009,29(9):663-666.
[2]Kuwabara T,Cogan DG. Studies of retinal vascular patterns,partⅠ:normal archit -ecture[J].Arch Ophthalmol,1960,64(12):904-911.
[3]A shton N. Studies of the retinal capillaries in relation to diabetic and other retinopathies[J]. Br J Ophthalmol,1963,47(8):521.
[4]崔彦,许迅,顾青.改良的视网膜血管消化铺片联合共聚焦显微镜观察——视网膜血管的三维检查方法[J].眼科,2006,15(2):140-141.
[5]潘琳,周水平,蔡晓频,等.糖尿病大鼠视网膜血管铺片技术的改进及形态学观察[J].中国组织化学与细胞化学杂志,2001,10 (4):456-457.
[6]Danaei G,Finucane MM,Lu Y,et al. National,regional,and global trends in fasting plasma glucose and diabetes prevalence since 1980:systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants[J]. Lancet,2011,378(9785):31-40.
[7]Global data on visual impairments 2010 [EB/OL]. http://www.who. int/mediacentre/factsheets/fs312/en/,2012.
[8]孙丰雷译.糖尿病与心血管疾病[M].济南:山东科学技术出版社,2008:261.
[9]Nakajima M,Cooney MJ,Alexander HT,et al. Normalization of retinal vascular permeability in experimental diabetes with genistein[J]. Invest Ophthmol Vis Sci,2001,42(9):2110-2114.
·论著:临床研究·